يجري تطوير جسيمات نانوية جديدة تحتوي على المغنيسيوم (Mg) والمنغنيز (Mn) بهدف استخدامهما في العلاج الإشعاعي-المناعي المتقدم للسرطان. هذه المقاربة تدمج بين قدرة الإشعاع على تدمير الخلايا السرطانية وبين تحفيز المناعة لمهاجمة الورم، مستفيدة من الخصائص الكيميائية الحيوية المميزة لكل من Mg وMn لتحسين الفعالية وتقليل الأعراض الجانبية.
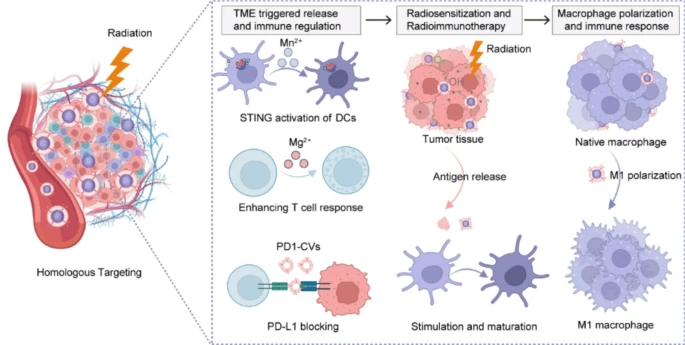
آليات عمل جسيمات Mg/Mn النانوية
تحفيز المناعة عبر المنغنيز (Mn):
أيونات المنغنيز تفعّل مسار cGAS–STING، وهو مسار رئيسي في المناعة الفطرية. عند تضرر DNA الخلايا السرطانية بالإشعاع وانتقاله إلى السيتوبلازم، يساعد Mn على التعرف عليه وتعزيز إنتاج الإنترفيرون (IFN) وتنشيط خلايا T القاتلة لمهاجمة الورم.
تعزيز الإشعاع عبر الجذور النشطة (ROS):
مكوّن MnO₂ في الجسيمات يتفاعل مع بيروكسيد الهيدروجين (H₂O₂) المرتفع في بيئة الورم، مولّدًا الأكسجين (O₂) والجذور الحرة. هذا يزيل نقص الأكسجة ويجعل الورم أكثر حساسية للإشعاع.
إحداث الموت الخلوي Ferroptosis:
المنغنيز يُحفّز موتًا خلويًا مبرمجًا يعتمد على بيروكسدة الدهون، ويزيد من إنتاج ROS ويُضعف مضادات الأكسدة (مثل الجلوتاثيون GSH) داخل الخلايا السرطانية.
تعزيز المغنيسيوم (Mg):
جسيمات MgCO₃ النانوية تُحسّن تأثير العلاج المناعي (مثل أدوية PD-1 inhibitors) من خلال دعم استجابة خلايا T وتوليد مناعة أقوى ضد الورم.
الهندسة الوراثية للجسيمات:
تسمح التعديلات الجينية بإضافة بروتينات أو لواصق موجّهة على سطح الجسيمات لزيادة الاستقرار والاستهداف المباشر للأورام، مع تقليل السمية على الأنسجة السليمة.
مزايا وتطبيقات في علاج السرطان
تآزر متعدد الآليات: الجمع بين فعالية الإشعاع وتنشيط المناعة يتجاوز حدود العلاج الأحادي.
إعادة تشكيل بيئة الورم: تحويل الأورام “الباردة” (المثبطة للمناعة) إلى أورام “ساخنة” (نشطة مناعيًا) لتصبح أكثر استجابة للعلاجات المناعية.
إيصال موجّه: التصميم النانوي والهندسة الوراثية يمكّنان من توصيل محفّزات الإشعاع والمناعة مباشرة إلى الورم.
مكافحة النقائل: تنشيط المناعة بشكل جهازي يمكن أن يهاجم أورامًا بعيدة أو ميكرو-نقائل (تأثير أبسكوبال).
علاجات شخصية: تصميم جسيمات نانوية كـ “لقاحات مخصّصة” تستهدف مستضدات محددة على الورم.
آفاق مستقبلية وتحديات
توحيد التصنيع: لا بد من تطوير طرق قياسية للإنتاج واسع النطاق وضمان الجودة.
السلامة والسمّية: رغم أن Mn عنصر نزر، فإن التعرّض المفرط قد يسبب سمّية عصبية، ما يستدعي دراسات سمّية متعمقة.
الترجمة السريرية: هناك حاجة لأبحاث إضافية لفهم الآليات داخل الجسم البشري وتحويل النتائج المبشّرة في النماذج الحيوانية إلى تجارب سريرية ناجحة.
باختصار: هذه الجسيمات النانوية تمثل جيلًا جديدًا من الطب النانوي المُدمج، حيث يجتمع الإشعاع والمناعة في استراتيجية واحدة أكثر ذكاءً واستهدافًا، لكنها ما زالت بحاجة إلى المزيد من الأبحاث قبل الوصول إلى سرير المريض.